CCIC KOREA, '화장품 신원료 허가 및 등록 자료 규범', '화장품 효능 평가 지침' 의견수렴안 주요 내용 제시
[코스인코리아닷컴 이효진 기자] 오는 2021년 1월 1일부터 시행되는 중국 ‘화장품관리감독조례(化妆品监督管理条例, CSAR)’에 맞춰 세칙 발표가 이어지고 있다. 지난 8월 28일 ‘화장품 신원료 허가 및 등록 자료 규범’에 이어 9월 1일 ‘화장품 효능 평가 지침’ 의견수렴안이 정식 공고돼 일정 기간 의견을 받아 내용을 수정한 후 정식 시행될 예정이다.
최근 발표된 법규는 유럽, 미국 등 선진국의 법규를 반영하고 있으며 ‘화장품 효능 평가 지침’이 시행될 경우 효능성 문구에 대한 증빙서류와 테스트를 요구해 제출 서류에 많은 변화가 생길 전망이다. 이에 중국 화장품 허가와 등록을 진행하는 업체가 반드시 알아야 할 사항을 CCIC KOREA가 정리했다.
# ‘화장품 신원료 허가 및 등록 자료 규범’ 따른 제출 자료는?
‘화장품 신원료 허가 및 등록 자료 규범(의견수렴안)’에는 제출자료에 대한 구체적인 지침이 담겼다. 먼저 신원료 등록을 위해서는 신청서와 연구개발 보고서, 제조공정, 안정성, 품질관리표준, 안전성 평가, 효능 근거, 기술요구와 실제 샘플 요구사항에 대해 기재해야 한다. 검사보고서는 CMA, CNAS 인증을 받았거나 국제적으로 통용되는 GCP(Good Clinical Practice) 또는 GLP(Good Laboratory Practice)에 부합해야 한다.
신원료 안전성 평가자료에는 독리학 안전성 평가자료와 위해물질 평가자료가 요구된다. 독리학 테스트는 제품 성분에 따라 각각의 독리학 테스트를 진행해야 하며 성분에 따라서 독리학 테스트 항목이 면제된다.
화장품 신원료 안전성 평가에 대한 요구사항
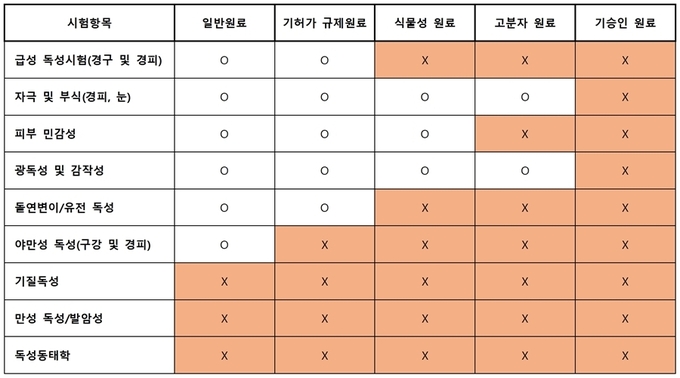
방부, 자외선 차단, 기미 제거·미백, 탈모 방지, 여드름 제거, 주름개선, 비듬 제거, 발한 억제 등의 기능성 신원료는 체외시험, 동물시험, 인체시험 중 1개 시험자료 제출이 필요하다.
중국 화장품 허가와 등록을 진행하는 업체는 3년간 매년 모니터링 보고서를 제출해야 한다. 모니터링 기간에는 원료 정보와 함께 부작용 모니터링, 위해성 평가·관리 자료에 대한 자료 제출이 요구된다. 부작용으로 인한 돌발상황은 별도로 보고해야 하며 원인 분석, 부작용과 결과, 조치, 처리결과 등을 제출해야 한다.
# ‘화장품 효능 평가 지침(의견수렴안)’ 무엇을 담았나
‘화장품 효능 평가 지침(의견수렴안)’에는 화장품 효능 증빙 자료에 대한 구체적인 요구사항이 포함됐다. 이에 따르면, 물리적 방식의 미백, 각질제거, 블랙헤드 제거 등은 효능 평가자료 제출이 면제될 수 있으며 제품의 효능에 따라 테스트 자료가 요구된다.
화장품 효능 증빙 자료에 대한 구체적인 요구사항
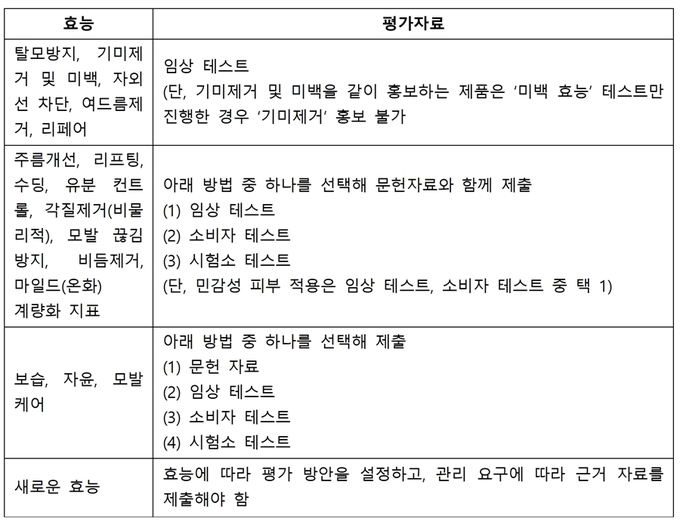
탈모 방지, 기미 제거·미백, 자외선 차단, 여드름 제거, 리페어 등의 효능에는 임상 테스트가 필요하다. 단, 기미 제거·미백을 같이 홍보하는 제품은 ‘미백 효능’ 테스트만 진행한 경우 ‘기미 제거’ 홍보는 할 수 없다. 주름개선, 리프팅, 수딩, 유분 컨트롤, 각질 제거(비물리적), 모발 끊김 방지, 비듬 제거, 마일드(온화) 계량화 지표 등의 효능을 가진 제품이라면 임상 테스트나 소비자 테스트, 시험소 테스트 가운데 하나를 선택해 문헌자료와 함께 제출해야 한다. 단, 민감성 피부 적용은 임상 테스트, 소비자 테스트 중 하나를 택해야 한다.
보습, 자윤, 모발 케어 효능의 제품은 문헌 자료, 임상 테스트, 소비자 테스트, 시험소 테스트 중 하나를 선택해 제출하면 된다. 새로운 효능의 제품일 경우 효능에 따라 평가 방안을 설정하고 관리 요구에 따라 근거 자료를 제출해야 한다. 아울러 문헌 자료가 외국어로 작성된 경우 효능과 관련된 부분은 반드시 중문으로 번역해야 한다.
# 미백 제품 임상 테스트 보고서 사용 위한 조건은?
미백 제품의 수가 많은 경우 임상 테스트 보고서를 동시에 사용하는 것도 가능하다. 미백 제품 임상 테스트 보고서 사용을 위해서는 ▲기미제거 미백 효능 성분의 종류와 함량, 품질규격, 제조사가 변하지 않아야 하며 ▲안전성을 보장한다는 전제하에 대표 제품의 효능 성분보다 함량이 같거나 많아야 한다. ▲제품 사용방식·제형에 변화가 없고 다른 성분에 의해 기미 제거 미백 효능에 영향을 주지 말아야 하며 ▲지정된 성분 허용 변화 범위를 충족하며 전체 변경된 성분의 농도가 다른 제품 처방의 10%를 초과하지 않아야 한다.
이러한 요구사항에 부합할 경우 대표 제품을 선택해 임상 테스트 진행 후 해당 테스트 보고를 다른 제품에도 사용할 수 있다. 단, 대표 제품 수량은 전체 미백 제품 수의 1/5 이상이어야 한다. 예를 들어 미백 제품이 10개일 경우 2개 제품 이상 임상 테스트를 진행해야 한다. 다른 제품은 대표 제품의 임상 테스트 보고서와 미백 성분의 일치성, 기타 성분의 변화에 대해 분석해 제출해야 한다.
CCIC KOREA는 "이번에 발표된 ‘화장품 신원료 허가 및 등록 자료 규범’과 ‘화장품 효능 평가 지침’ 의견수렴안은 유럽과 미국 등 선진국의 법규를 많이 반영하고 있고 정식으로 시행될 경우 효능성 문구에 대한 증빙서류와 테스트 결과 등 제출할 서류가 많아지는 등 큰 변화가 생길 것으로 전망된다"고 말했다. 이에 따라 국내 업체는 ‘화장품 신원료 허가 및 등록 자료 규범’과 ‘화장품 효능 평가 지침’ 의견수렴안을 꼼꼼히 살펴보고 사전에 철저하게 준비를 해야 한다고 강조했다.
(자료 제공 : CCIC KOREA)
이효진 기자 cosinpress@cosinkorea.com
Copyright ⓒ Since 2012 COS'IN. All Right Reserved.
오늘 많이 본 뉴스
한 주간 많이 본 뉴스
서울특별시 금천구 디지털로 178 가산퍼블릭 B동 1103호 전화 02-2068-3413 팩스 : 02-2068-3414 이메일 : cosinkorea@cosinkorea.com 사업자등록번호 : 107-87-70472 통신판매업신고번호 : 제 2013-서울영등포-1210호 청소년보호책임자 : 박지현 개인정보관리책임자 : 박지현 코스인코리아닷컴의 모든 컨텐츠는 저작권법의 보호를 받습니다. 무단 전재·복사·배포 등을 금지합니다. Copyright ⓒ Since 2012 COS'IN. All Right Reserved.